
面对干细胞治疗的很多不确定性,我们应当理性看待。本文盘点了近14年全球间充质干细胞的临床研究现状,包含临床试验数量,细胞来源,疾病种类,给药途径,专利拥有情况,细胞剂量等。
撰文:Cel G
修订:步步先生
1976年,Freidenstein等人首次发现在骨髓里存在一群不均一的细胞群,这种细胞在体外培养时,呈贴壁生长,形态和成纤维细胞相似,呈克隆性增殖,并提出“骨髓间充质干细胞”(Mesenchymalstem cells,MSCs)的概念。如今,MSCs已从人类许多其他来源组织中分离和鉴定出来,包括脂肪组织、骨骼肌、脐带血和华尔通胶等。
我们以“干细胞”为关键词搜索,在“中国知网数据库”检索,得到26万条结果。其中,与“间充质干细胞”关键词相关的可达32%,其研究热度可见一斑。
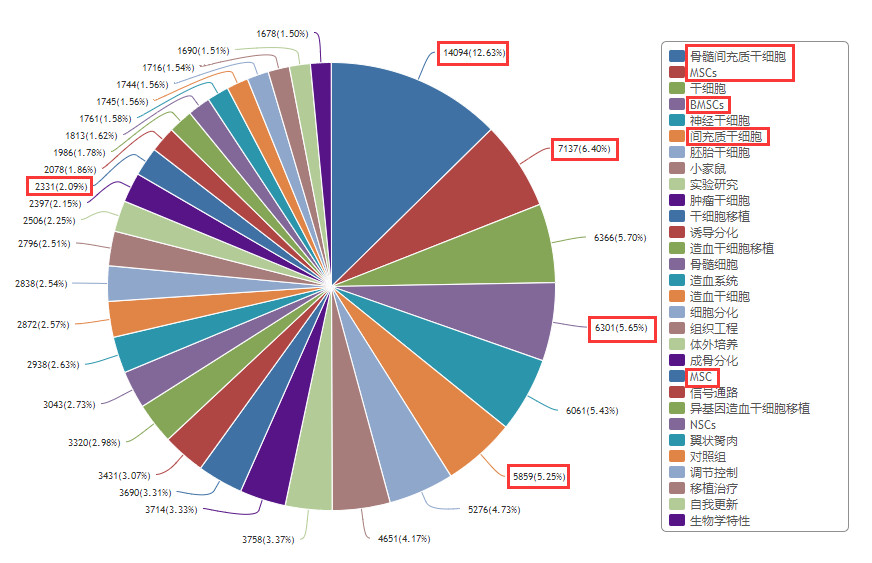 图1:在知网上搜索“干细胞”,间充质干细胞相关关键词占比32%
图1:在知网上搜索“干细胞”,间充质干细胞相关关键词占比32%
近期,美国学者Maciej Kabat等人在国际期刊《干细胞转化医学》上刊登了一篇报道,他们使用关键词“Mesenchymal”,对2019年3月19日前登记在美国国立卫生研究院(NIH)临床试验登记系统(ClinicalTrials.gov)上的914项间充质干细胞临床试验进行了多维度分析。
亮点其一就是,针对细胞治疗的给药途径和使用剂量进行了汇总分析。这两种因素以前并未专门提及,而这是影响细胞治疗效果的重要因素。
经统计发现,在2007 - 2012年期间,全球注册的MSCs临床试验呈快速增长,随后进入一个平台期,在2018年又出现“陡降”。对此,本文做一简单评述。
全球每年新增临床试验的数量,体现了研究的增量。而不同阶段临床试验的占比,也可以看出整体临床研究的进展:
1期临床试验重点考察「安全性」
2期临床试验初步考察「有效性」
3期临床试验全面考察「有效性」
3期临床试验成功后,新药就可以申请(上市销售)了。其后4期临床试验,可以在细胞药物销售阶段进行。临床试验的“夭折”几率是非常高的,特别是进入2/3期的。需要特别指出的是,出于对患者安全负责的态度,安全性评估会贯穿整个1-4期临床试验。
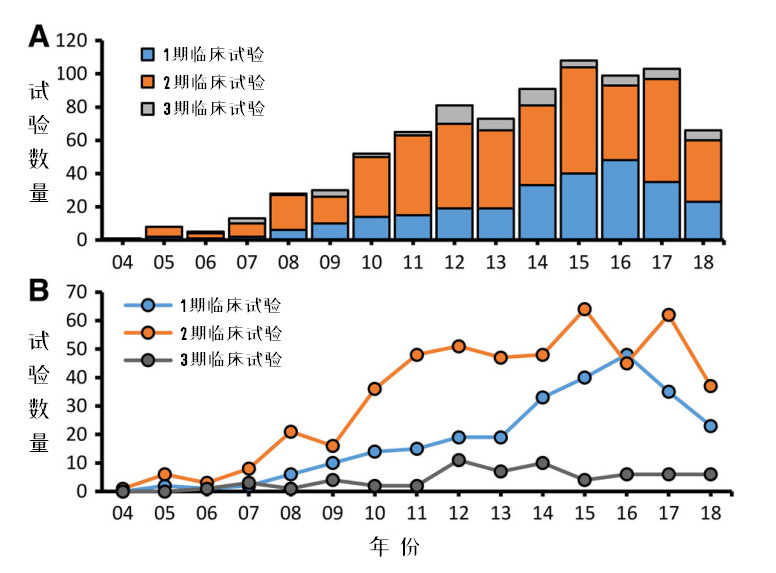 图2:每年新增临床试验,按阶段分类
图2:每年新增临床试验,按阶段分类
图2是全球MSCs临床试验的情况,A图反映总量,B图反映各个阶段临床试验的趋势。
1期临床试验在2014年前呈稳步增长趋势,之后陡升,到2016年达峰值,此后有所回落。这一数据反映出每年注入整个MSCs 临床试验项目的增量。
纵观整个临床试验,处于2期的占比最高。从全球MSCs的整体临床试验分析,安全性评估基本都可通过,但很多临床试验都止步于有效性评估。整体趋势是,从2007年起开始快速增长,到2011年以后进入一个相对稳定的平台期。
3期临床试验在2012 - 2014年间达到顶峰,最高达到了近12%的峰值,此后又回落到6%以内的比例。
目前,完成3期临床试验有3种MSCs产品:Mesoblast(已经提交上市申请,尚未获批)、Alofisel(已在欧盟获批上市销售)、Stemirac。
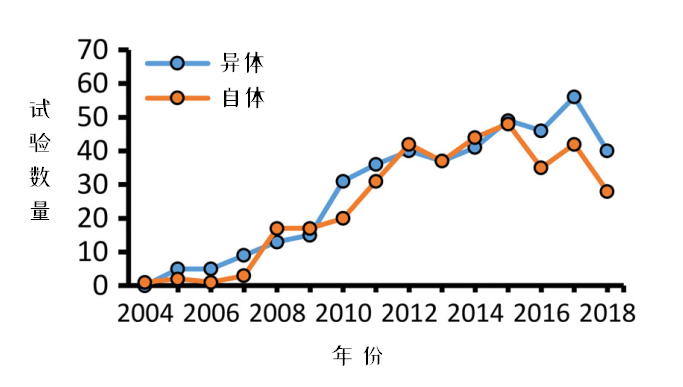 图3:每年新增临床试验,按自体/异体来源分类
图3:每年新增临床试验,按自体/异体来源分类
从每年新增的临床试验变化看,使用同种异体来源MSCs进行的临床试验在2015年,首次超过了自体。研究者认为可能与干细胞库增多有关。
然而小编不这么认为,小编发现可能与MSCs组织来源有关,因为骨髓和脂肪组织来源的MSCs临床试验数量在减少(图4),而这两种组织来源的MSCs是自体应用的主力。从这个角度看,也解释了为什么2018年MSCs临床试验会“陡降”。
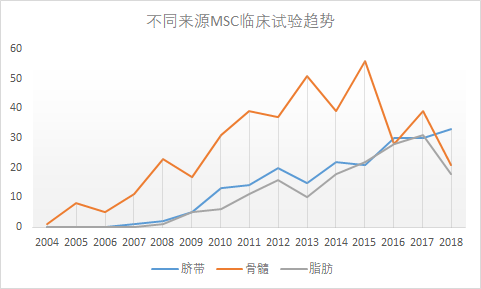 图4:不同来源MSCs临床试验趋势
图4:不同来源MSCs临床试验趋势
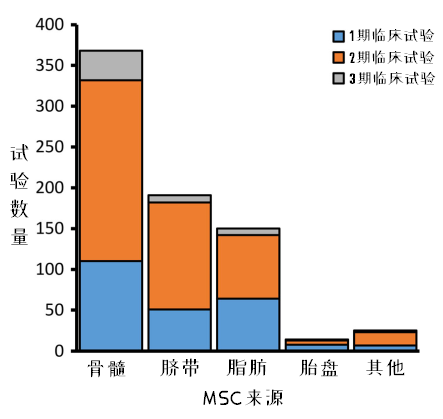 图5:不同来源的MSCs临床试验情况
图5:不同来源的MSCs临床试验情况
在临床试验中,最多使用的MSCs来源于骨髓,其次分别是脐带、脂肪和胎盘。相对而言,骨髓MSCs研究中,3期临床试验的占比最高。(注:在这里,研究者将脐带血来源MSCs统计入了脐带来源,下文中出现的脐带也一样。)
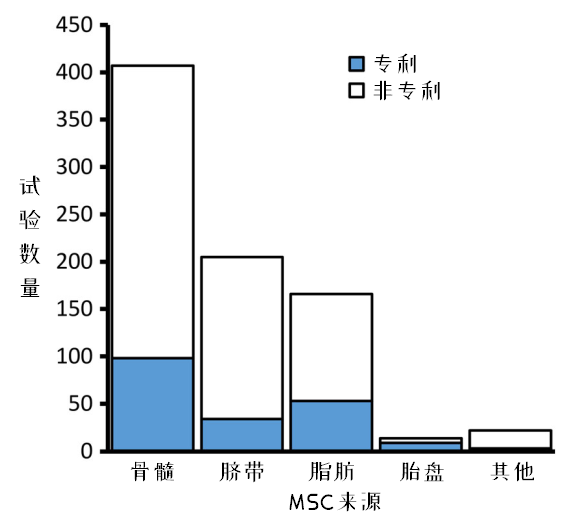 图6:不同来源MSC临床试验的专利化程度
图6:不同来源MSC临床试验的专利化程度
图6.反映了MSCs临床试验中企业的参与情况,有24%的临床试验拥有专利专利细胞产品。按其比例排序,胎盘>脂肪>骨髓>脐带>其他。
这可能反映了胎盘和脂肪中的MSCs来源更复杂,制备技术更多样化,相对容易形成专利技术。
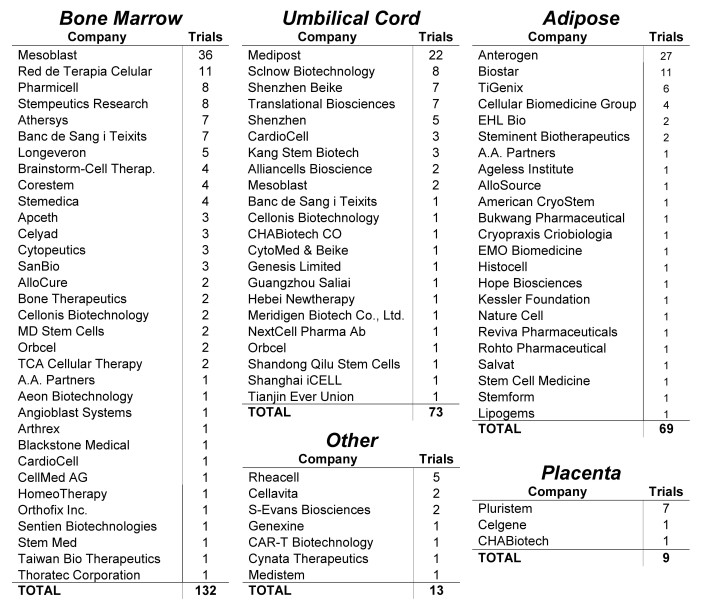 图7:各公司开展MSC临床试验情况
图7:各公司开展MSC临床试验情况
在注册的MSCs临床试验,总共82家公司参与。有3家开展的临床试验就占比30%,他们分别使用不同组织来源的MSCs产品:Mesoblast(骨髓)、Anterogen(脂肪)和Medipost(脐带)。
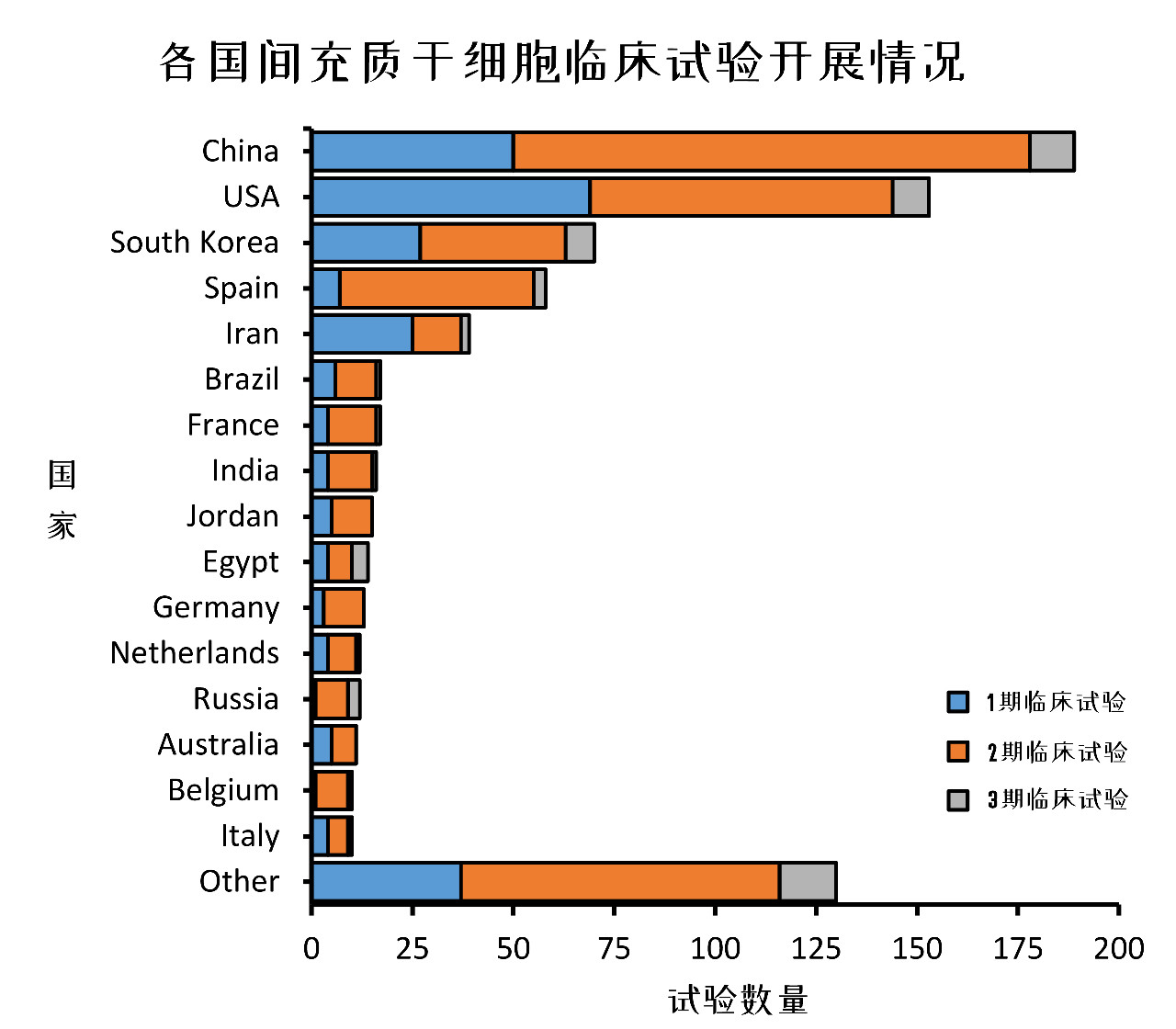 图8:各国注册MSCs临床试验情况
图8:各国注册MSCs临床试验情况
从国家来区分,中国(22%)的MSCs临床研究最多,美国其次(19%)、韩国、西班牙和伊朗紧随其后,欧盟加起来大概占17%。
你没看错,在这张图上并没有干细胞研发强国日本(大概是因为日本以iPSC开发为主)。
在2005 - 2017年间,日本只开展了6项MSCs临床试验,其中4项使用了脂肪MSCs,4项治疗肝脏疾病,迄今没有一项进入3期临床试验的项目。
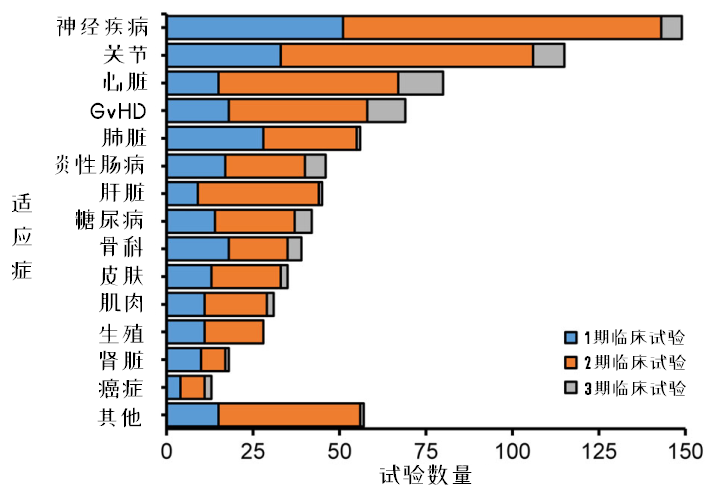 图9:MSCs临床试验适应症的开展情况
图9:MSCs临床试验适应症的开展情况
Maciej Kabat等人将临床试验适应症分为14类,无法分类或数量太少归为其他。其中,在注册的适应症中,神经系统疾病(17%)和关节疾病(15%)最多,其次是心脏疾病(8.8%)和GvHD(8.3%),后两者的3期临床试验占比更高。
剩下的适应症大致分为:
占比5%左右:糖尿病、炎性肠病、骨科、肝脏、肺部疾病;
占比3%左右:肌肉、生殖、皮肤疾病;
占比更低:败血症、癌症、血液、肾脏疾病。
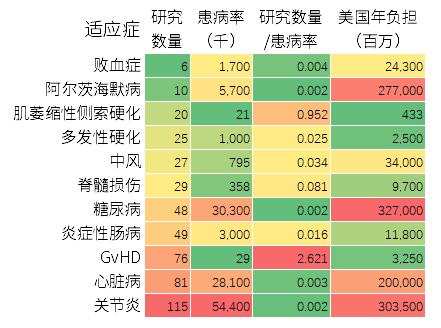 图10:MSCs临床试验的适应症与患病率的关系
图10:MSCs临床试验的适应症与患病率的关系
研究者还统计了某些疾病的患病率及其给美国社会带来的经济负担,并和相应的研究数量进行了对比。年负担能体现相应细胞产品的市场前景,糖尿病、关节炎、阿尔茨海默症和心脏病排在前列。
从研究数量与患病率的对应相关性来看,GvHD研究最多,肌萎缩侧索硬化症次之。对应相关性偏少的适应症有:败血症、阿尔茨海默症、糖尿病、心脏病和关节炎。
关于关节炎、心脏病和糖尿病的注册MSCs临床试验的绝对数量排在第1、第2.和第5位,但患病率却大大高于其他疾病,这是其对应相关性偏少的原因。而败血症则可能是现有治疗手段能解决问题,由于市场份额小,因此研究少。
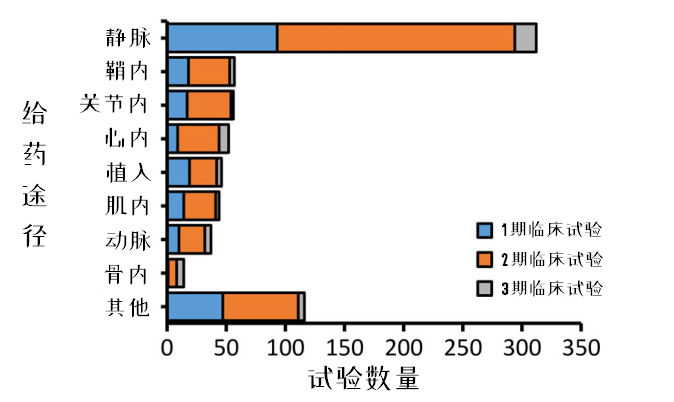 图11:区分给药途径的MSC临床试验开展情况
图11:区分给药途径的MSC临床试验开展情况
在914项临床试验中,只有84%能明确给药途径。
在目前已知的8种给药途径中,主要通过循环系统给药(其中静脉占43%,动脉占5%)。静脉输注由于操作简便、侵袭性小、可重复性强,所以治疗中最常使用。
此外,有36项试验(4.6%)进行了两种以上的给药途径。
有多项临床试验使用了生物材料或基质来递送MSCs,在图中以“植入”代表其给药方式。3期临床试验占比最高的给药途径分别是静脉给药、骨内给药(骨髓腔内)、心内注射给药。
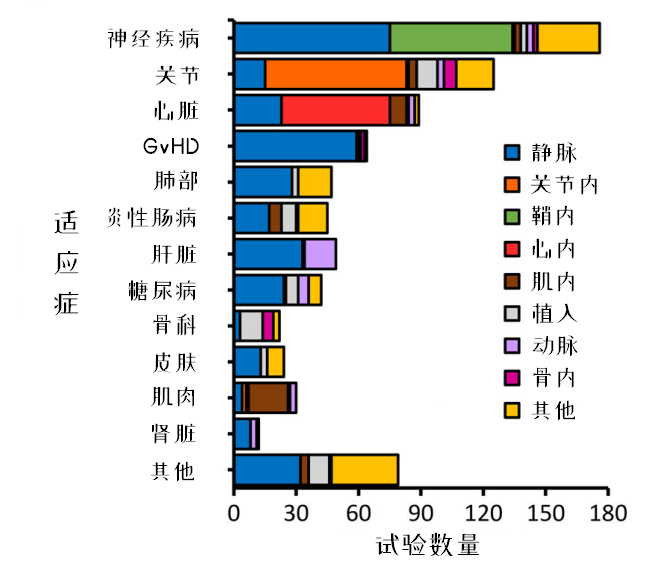 图12:区分适应症来看给药途径的差异
图12:区分适应症来看给药途径的差异
静脉输注的给药方式使用频率最高,但某些疾病有自己独特的给药方式。比如关节的关节腔内注射,心脏的心肌注射,肌肉的肌内注射。值得注意的是,在神经疾病的给药方式中,静脉输注的使用频率依然超过了鞘内输注,可能是出于安全考虑。
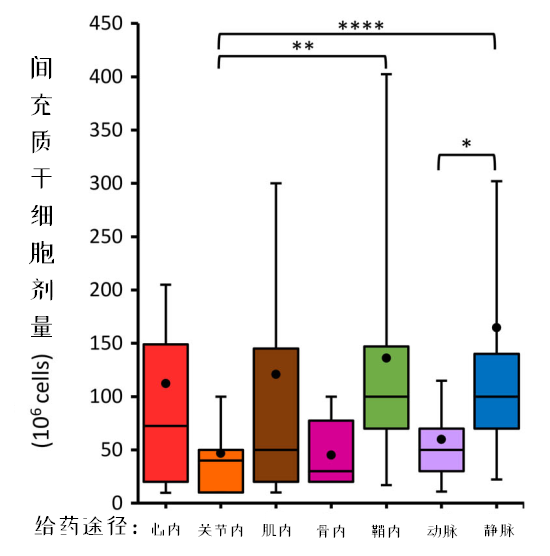
细胞剂量是影响临床试验疗效的关键因素,而在检索的临床试验方案中,仅有53%的数据包含细胞剂量。为了统一标准,研究者将以每kg体重表示的细胞剂量,按人均70kg体重进行了换算。
结果发现,静脉输注的细胞量最高,心脏内和肌肉输注的细胞量范围跨度较大,关节腔、骨内和动脉输注的细胞量范围跨度较小。 为了探索最佳剂量,分析了同时出现有效剂量和无效剂量的研究。结果,有16项静脉输注、3项关节腔内输注的研究符合要求。
同时发现,剂量与效果之间的关系呈倒U型:过高和过低的剂量都效果不佳。研究者推测免疫调节过度是过高剂量反而无效的原因。
在16项采用静脉输注给药的MSCs临床试验中,14项的最低有效剂量在70 - 190 X 10*6/人次之间,超出这个区间的剂量无效。 其余4项剂量递增试验结果表明,MSCs的最低有效剂量在一个更狭窄的区间内:100 - 150 X 10*6/人次之间,剂量过低或过高都会降低其有效性。
此外,3项关节腔给药的临床试验结果显示,最低有效剂量范围在50 - 100X10*6/人次之间,10X10*6/人次和150X10*6/人次的剂量无效。
本次研究只归纳出,静脉输注给药和关节腔内给药这两种给药途径可能适用的最低有效剂量区间。
全球已开展了大量的MSCs临床试验,安全性得到广泛验证,但上市的干细胞产品寥寥无几。
很多学者分析了这一现象,MSC治疗机制尚不明确是一个原因,更主要的是MSCs临床试验的个体化差异比较大,缺乏可比性、可重复性差。影响其治疗效的因素太多:
▪不同组织来源MSCs的异质性
▪不同的细胞制备工艺流程
▪不同的传代次数(这个用倍增时间更合适)
▪不同的给药途径
▪不同的剂量范围
▪不同的疾病差异
其中有些因素可以通过制定标准化来改善。标准化产品,这涉及到细胞行业的痛点。为了保护知识产权,很多公司都不会披露过多信息,使得比较不同研究变得很复杂。
咨询公司ZS Associates的CEO玛丽亚·惠特曼(Maria Whitman)表示,“在短期内,整个行业内的标准化,不太可能成为标准化的重点…”
剂量信息在临床试验数据中相对难获取,为什么难以获取,或许我们可以做一个猜测。剂量和给药途径,在美国是受知识产权保护的,但在欧洲和中国是不被保护的,这或许是原因。
为此,小编咨询了两位科研人员,但得到了矛盾的两个结论(保护 vs 不保护)。于又咨询了广东华商律师事务所柏永权律师。柏律师表示,根据《中华人民共和国专利法》第25条,对于疾病的诊断和治疗方法不授予专利权。《药品管理法实施条例》第35条也有相关规定,但保护范围太窄,无法保护新用途药物,新剂量或新的给药途径。
目前,MSCs临床试验的主要治疗目标达成率低。研究者建议,在早期研究中就同时开展有效性的剂量研究,探索最低有效剂量。
静脉输注后,MSCs会在很短时间被免疫系统清除。研究者建议:以最低有效剂量间隔一段时间重复注射,强化短期效应,改善人体免疫微环境。
此外,研究者认为一些新技术会带来积极的改变。譬如封装MSCs,可以避免细胞间接触,明确为旁分泌机制发挥作用,且有利于慢性疾病治疗。
最后,研究者还给出了静脉输注的分组建议:
低剂量组 ~75X10*6/人次
中剂量组 ~150X10*6/人次
高剂量组 ~300X10*6/人次
参考内容: Trends in mesenchymal stem cell clinical trials 2004‐2018: Is efficacy optimal in a narrow dose range? STEM CELLS Transl Med. 2019; 1– 11.