

Cell:超11年追踪揭示免疫压力对癌症转移进化的作用
免疫评分(ImmunoScore, IS):是一种将肿瘤微环境中的T细胞和细胞毒性T细胞的密度进行量化的标准检测方法,对肿瘤的转移及预后判断具有重要的价值,目前已被证明可预测早期和晚期结直肠癌患者的临床结果。
免疫编辑(Immunoediting):2002年,免疫学家Schreiber和Dunn提出了著名的“肿瘤免疫编辑学说”,即免疫系统抑制肿瘤生长的同时肿瘤的恶性程度逐渐强化,在免疫系统和肿瘤的相互作用中,免疫系统发挥着双重作用:在肿瘤发展过程中免疫系统会依次出现免疫清除、免疫平衡和免疫逃逸三个阶段,免疫系统既发挥抗肿瘤效应,同时又对其进行压力选择,使得肿瘤细胞发生免疫重塑而导致肿瘤的发生发展。
肿瘤微环境(Tumor Microenvironment, TME):是肿瘤细胞赖以生存和发展的复杂环境,肿瘤微环境由细胞成分和非细胞成分组成。其中细胞成分包括肿瘤细胞本身、炎症细胞、免疫细胞、间充质干细胞、内皮细胞以及与肿瘤相关的成纤维细胞等;非细胞成分主要包括细胞因子,趋化因子等。如今研究火热的肿瘤免疫检查点抑制剂针对的就是所处肿瘤微环境中的免疫细胞,扭转微环境中免疫抑制的现况,再度恢复机体免疫系统对肿瘤细胞的攻击能力从而起到抗肿瘤效应。
免疫豁免(Immune-Privileged):是指机体某些部位对外来抗原及自身抗原免疫反应很弱,以防止因免疫反应引起的组织损伤和功能紊乱。免疫豁免区即发生免疫排斥较弱的区域,包括眼球晶状体,睾丸和中枢神经系统。这些区域可能因为长期缺乏抗原提呈细胞的刺激致使细胞表面缺乏特异性受体而无法与免疫细胞发生免疫应答或者只发生较弱的应答反应。
超长时间以及相对大量的切除样本跟踪分析肿瘤克隆进化,建立一个平行选择模型解释免疫编辑对癌症转移进化的作用。
免疫评分和免疫编辑可描绘不同的免疫逃逸机制
非复发性克隆是受免疫编辑的;进展中的克隆具有免疫豁免性
免疫编辑和免疫指数是复发转移的两个最佳预测因子
平行选择模型描述了克隆免疫编辑和肿瘤进化
研究人员假设肿瘤细胞的转移进展和克隆进化是由肿瘤内在特征以及外在免疫压力介导的,遵循达尔文选择的肿瘤克隆基础,即在免疫清除期根除高免疫原性肿瘤克隆,而选择具有低免疫原性和抗免疫攻击性的肿瘤细胞变体进入平衡期。
据此,研究人员试图对转移性结直肠癌(CRC)患者进行为期11年的随访,研究免疫压力如何影响转移肿瘤的进化。
该研究描述了不断演变的转移基因组和免疫微环境,同时描述了免疫监视、逃逸、克隆传播与肿瘤进展之间的联系。在此,研究人员提出了在转移过程中肿瘤进化的平行选择模型,其进展取决于局部免疫应答的强度和质量。
实验选取2例IV期CRC患者的31例转移灶作为纵向数据集,这2名患者存活时间极长。在疾病进展中,对2名患者P210和P45的转移灶内与灶间不同的时间部位进行取样(包括完全切除的原发肿瘤,同步及异时转移灶),共36个样本,并通过全外显子组测序、免疫组化(IHC)淋巴谱系标记物定量来进行基因组和肿瘤微环境表征,用以评估转移内、转移间和患者间的基因组和免疫异质性。
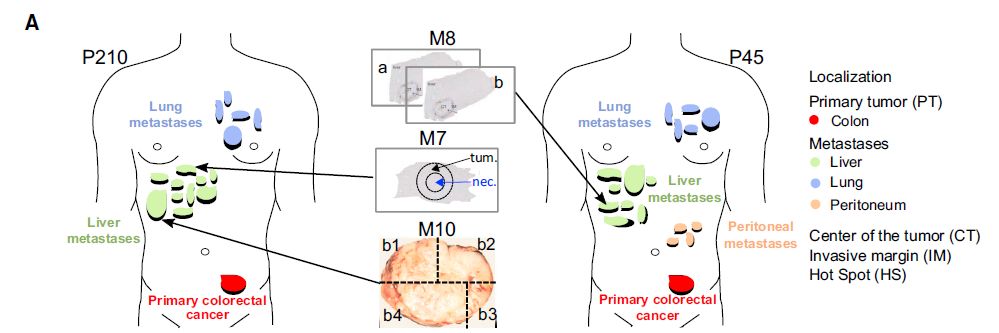 图1:两名患者的取样分布
图1:两名患者的取样分布
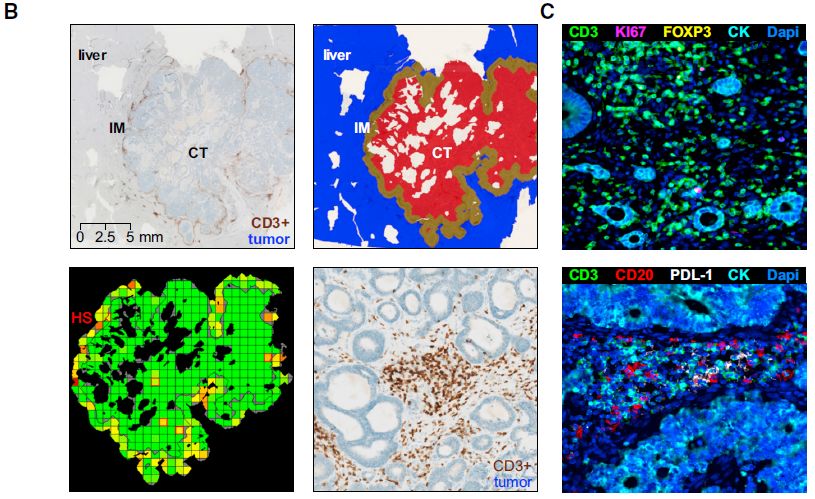 图2:IHC全片数字扫描和标记物复合荧光成像
图2:IHC全片数字扫描和标记物复合荧光成像
实验使用Parsimony Ratchet方法构建系谱树。总体而言,与从解剖学上分离的转移相比,来自相同转移位置的样本在系统发育上更接近并且共享更多突变。
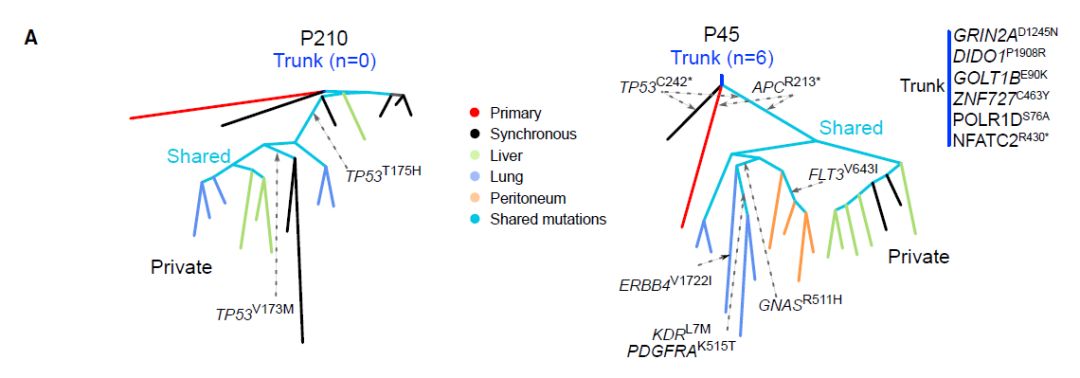 图3:基于原发和转移样本一致突变的系谱树
图3:基于原发和转移样本一致突变的系谱树
接下来根据编码突变谱的相似性推断出每个转移的起源,父子关系由最高的Jaccard相似系数定义。然后,从诊断时间到最后一次随访,用转移灶进化系谱树显示转移性传播的途径,每个样本用圆圈表示,圆圈大小表示肿瘤尺寸大小,外圈颜色为切除位点,内圈颜色表示免疫指数(HS和WS)。在患者P210中,肿瘤部位M10-b3是大体积转移M10的组成部分,但其起源不同于从相同转移(M10-b1/-b2/-b4)取样的其余区域,表明M10是多步定植的结果。值得注意的是,在两名患者中,只有一例同一时期转移扩大为转移谱系:P210中的M6和P45中的M3,表明一些转移灶比其他转移灶更具攻击性。
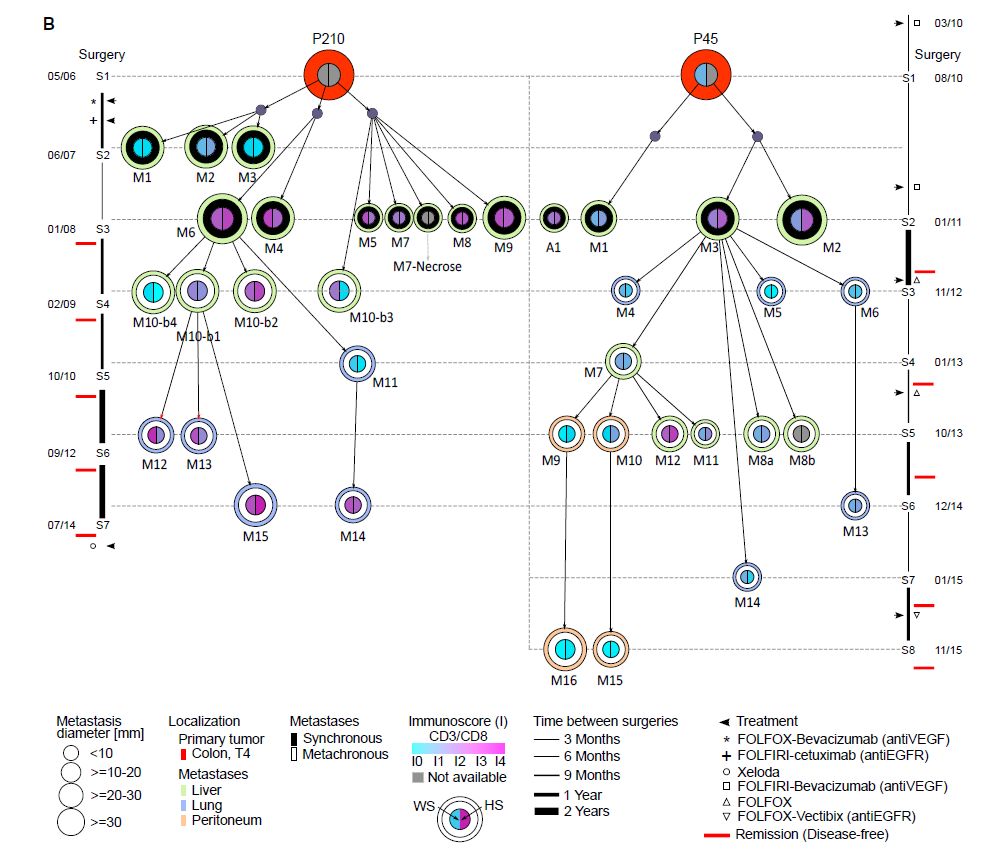 图4:转移灶传播树形图
图4:转移灶传播树形图
尽管有线性进化模型的迹象,但存在平行进化的要素,例如原发和转移性肿瘤之间的高水平遗传分化。此外,在转移M6中观察到TP53的平行进化,其中在两个不同的克隆中检测到两个突变的基因座(患者P210的持续型克隆1和消除型克隆12)。同时,实验观察到在几个转移瘤中,独特的肿瘤克隆正在进行进化。 此外,患者P210在空间异质性M10样品中存在不同的肿瘤克隆现象,这也证明了转移灶内克隆的异质性。
基因组印记变化方面,通过将测序覆盖度、拷贝数变异和肿瘤纯度整合来估计给定体细胞突变的细胞流行率,可计算得到12种不同的肿瘤克隆。其中,没有检测到原发病灶的主克隆,可能的原因是原发肿瘤的取样有限,然而疾病进展期间最持久的克隆可追溯到原发性肿瘤。
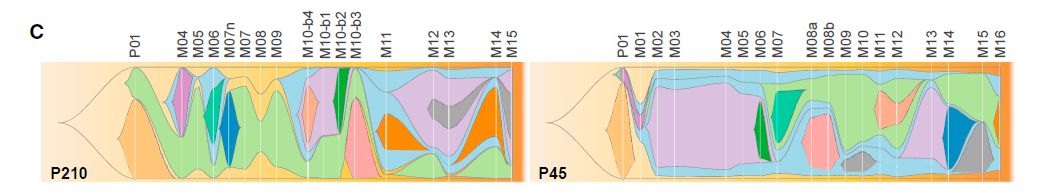 图5:肿瘤克隆进化图
图5:肿瘤克隆进化图
对于这两位患者而言,在随访时间线上某一点发展的12种不同的肿瘤克隆超过克隆检测阈值10%,具有相似克隆突变的转移灶在解剖学上,时间上和系统发育上密切相关。
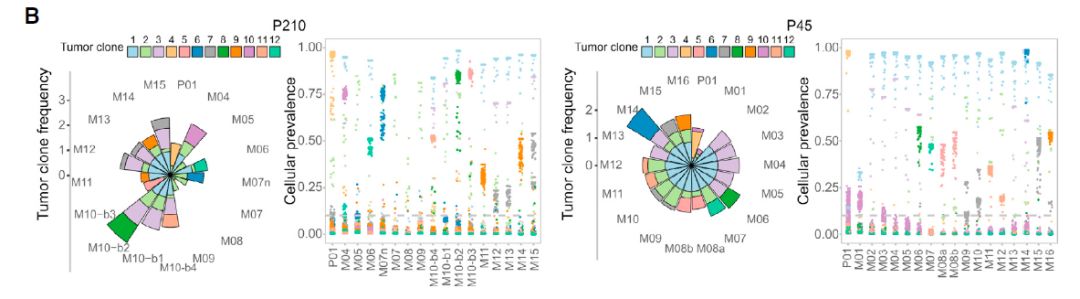 图6:肿瘤克隆超过检测阈值的10%
图6:肿瘤克隆超过检测阈值的10%
为了阐明免疫背景,实验通过单重IHC,多光谱成像和多重免疫基因表达来检测肿瘤浸润淋巴细胞。总体而言,P210和P45转移灶的表型差异较大。
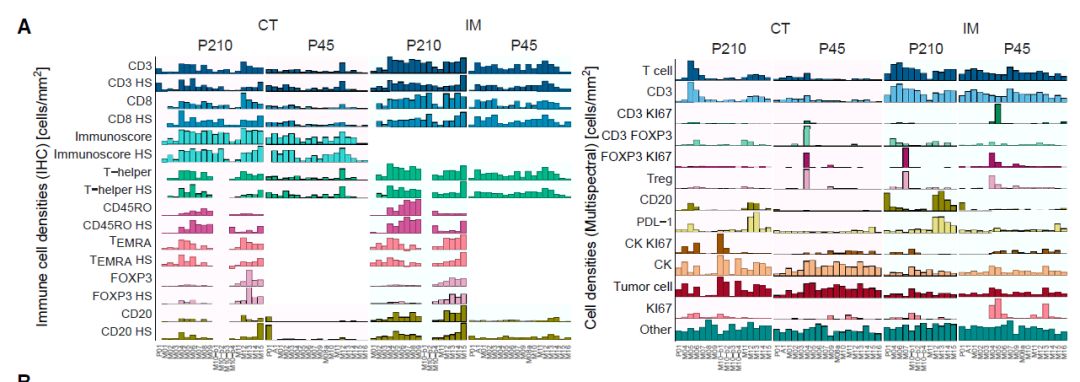 图7:免疫细胞密度柱状图
图7:免疫细胞密度柱状图
单独对每个转移灶进行免疫编辑评分,把观察到的每个非同义突变作为预估的免疫原性突变比率,通过绘制免疫编辑评分(Yes/No)及相应的免疫评分值(Hi/Lo)定义四类转移瘤:HiYes、HiNo、LoYes和LoNo。高于预估的免疫原性突变率表明缺乏免疫编辑和免疫耐受(得分>0.8,n=24)。
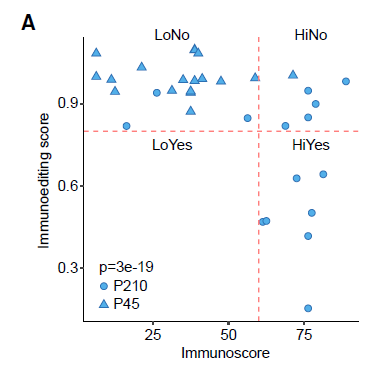 图8:免疫编辑评分与免疫原性突变率
图8:免疫编辑评分与免疫原性突变率
然而,54%具有高免疫评分的转移瘤是进行过免疫编辑的。这一结果表明,免疫浸润是免疫编辑发生的必要不充分条件,并且免疫编辑发生在转移期。此外,免疫编辑与各类T细胞表型(如细胞毒性,粘附,Th1,Tfh,CD8细胞,趋化因子CCL2,细胞因子和免疫检查点等)均具有很强的相关性。
在肿瘤浸润淋巴细胞(TILs)存在下鉴定无免疫编辑的一组转移灶揭示了肿瘤-外在逃逸的几种机制。在HiNo组(免疫编辑评分>0.8,免疫评分>60),CT和IM显示了FOXP3+细胞和PD-L1+细胞的密度增加,通过测量不同克隆型的数量来判断较高的TCR-a多样性,表明该组中T细胞克隆扩增的缺失或不足。
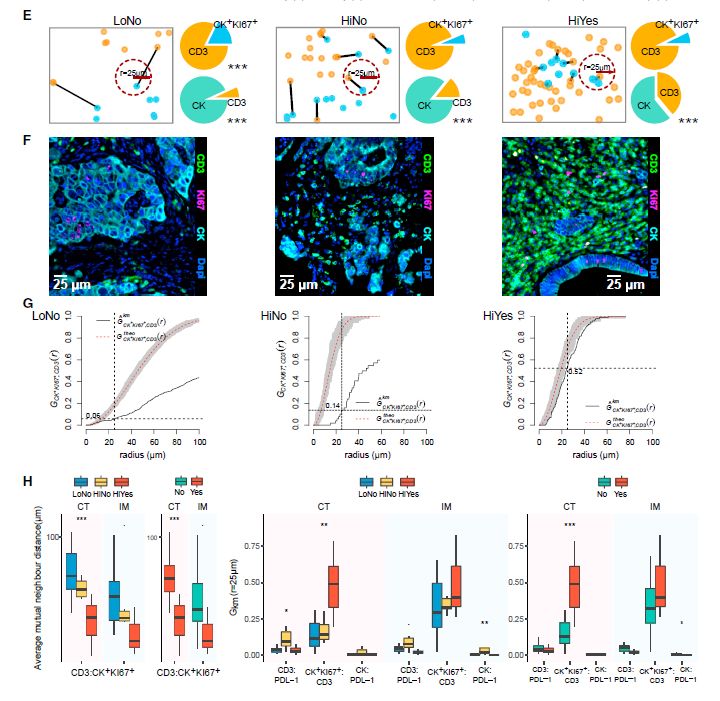 图9:免疫评分和免疫编辑揭示了不同的逃逸机制
图9:免疫评分和免疫编辑揭示了不同的逃逸机制
因此,免疫编辑的转移灶具有高免疫评分和T细胞与增殖的肿瘤细胞之间短距的特点,而非免疫编辑转移灶的FOXP3+T细胞密度增加,PD-L1表达增加,以及T细胞与PD-L1+细胞显着接近。
为了解肿瘤复发风险的特征,根据肿瘤克隆是否已经产生子代转移将肿瘤克隆分为三组(持续型,消除型和早期非复发型)。
实验通过几种基因组特征(包括Dn/Ds评分)比较了持续型和消除型肿瘤克隆,并且计算了肿瘤克隆的免疫编辑评分。值得注意的是,免疫编辑在消除型肿瘤克隆中更为常见,而免疫编辑的缺失在持续型克隆中较为普遍(只有一个来自P45克隆2的持久型克隆具有免疫编辑,而这个克隆只有一个位于ZDHHC11基因内的免疫原性突变,其表达水平可以忽略不计)。
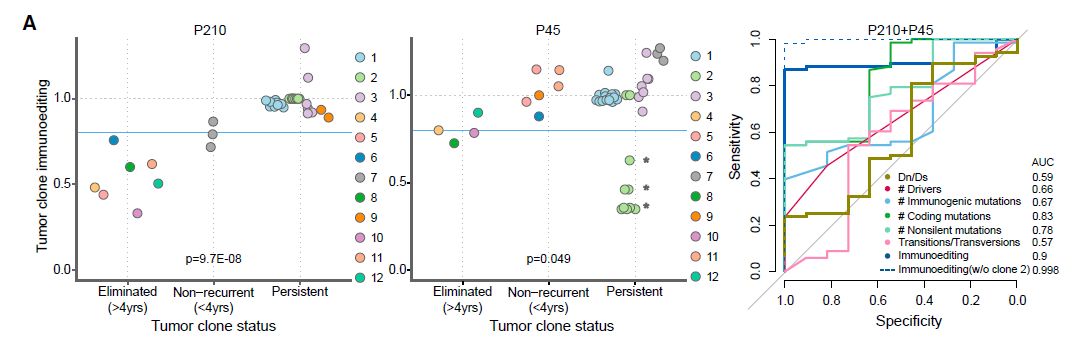 图10:免疫编辑区分三型肿瘤克隆
图10:免疫编辑区分三型肿瘤克隆
实验结果显示,使用免疫选择来区分持续型和消除型克隆优于Dn/Ds评分;来自相同转移的不同克隆具有不同的免疫编辑评分,免疫编辑是肿瘤克隆复发较为理想的预测因子(AUC = 0.89),并且若除去P45克隆2的影响因素,则更佳(AUC = 0.98)。在具有异时转移的卵巢癌病例中观察到类似的结果。
最后,研究人员检验了具有临床相关性的参数,对包括临床、基因组、免疫和空间等22个参数进行单元变量分析。免疫编辑和免疫指数是转移复发的两个有效的最佳预测因子。研究显示,较低的免疫指数,免疫编辑的缺失和较高的转移负荷对无复发存活率具有不利影响。
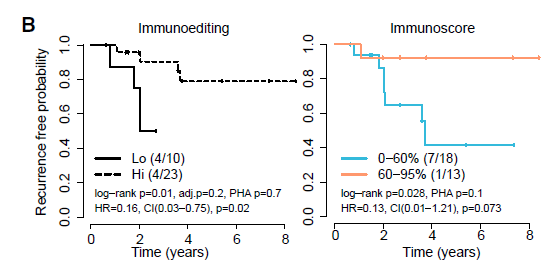 图11:免疫编辑(左)和免疫评分(右)的单变量无复发生存曲线
图11:免疫编辑(左)和免疫评分(右)的单变量无复发生存曲线
通过将免疫编辑和免疫指数叠加在转移灶传播树形图上来评估免疫系统与肿瘤随时间传播之间的关系。这说明了转移灶的局部控制(较小的尺寸)和免疫指数在预防复发中起到保护作用。因此,转移进展和复发时间取决于机制相关的免疫参数。
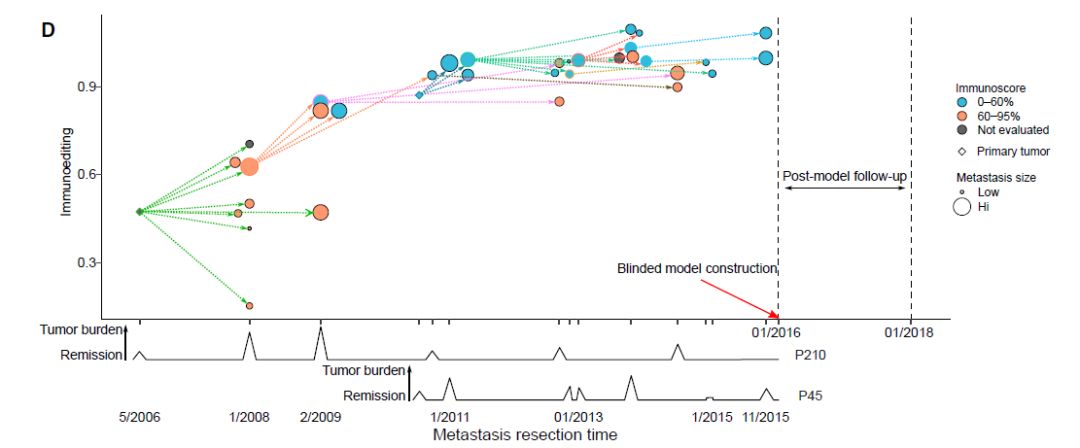 图12:叠加免疫编辑和免疫指数的转移灶传播树形图
图12:叠加免疫编辑和免疫指数的转移灶传播树形图
该实验通过对特长生存期(超过11年)以及相对大量的切除样本的追踪研究,揭示了免疫系统在转移复发过程中所起到的作用:
(1)每个转移灶本身就是一种疾病,时间及空间异质性的转移灶,甚至是同一转移灶内都存在不同的临床反应、基因组结构和免疫活性,因此转移灶不能平均化处理。 (2)实验通过平行选择模型描述了转移进化图谱,用以追踪肿瘤的多种传播途径。然而,当仅考虑基因组学特征时,肿瘤克隆是否易于传播不能很好的得到解释。 (3)实验在时间和空间维度分析了与肿瘤克隆相关的免疫微环境,证实了非复发性克隆是受免疫编辑的,持续型和进展的肿瘤克隆具有免疫豁免性。这一发现首次揭示了克隆传播和免疫监视之间的关系,对治疗有重要意义。靶向克隆新抗原可以通过靶向保留免疫原性突变的、持久的、未经编辑的肿瘤克隆来预防复发。 (4)实验虽然可以在疾病时间表中检测到有效的免疫激活和高免疫,但随着时间的推移,免疫编辑的总体下降趋势意味着肿瘤获得免疫逃逸。越来越多的证据表明,在获得大量突变之前,染色体不稳定性可能是转移的早期驱动,患者P45由此可见,这可能导致新抗原的浓度稀释和自身肽对抗原呈递的竞争优势。在这种情况下,监视的免疫细胞募集将被沉默,免疫编辑也将无法检测。此外,研究人员发现未经编辑的高免疫浸润转移灶也具有高倍性,分析可能的原因是肿瘤细胞已经充满新抗原,染色体不稳定性在此之后。在产生足够强的新抗原信号后,免疫细胞可被募集,但受到免疫抑制的影响,导致无法检测到免疫编辑。实际上,在肿瘤浸润淋巴细胞(TILs)存在下缺乏免疫编辑揭示了几种逃避机制,包括增加免疫抑制细胞的密度和从肿瘤细胞中分离免疫细胞。 (5)免疫指数、转移灶大小以及缺乏编辑是复发的独立预后因素。实验构建的转移性癌症进展的预测模型,可以正确预测两名患者的复发风险,也成功在另外独立集上得到验证。 上述研究可为了解癌症传播和免疫治疗的发展提供有效依据。 参考文献: