
近年来,CAR-T细胞因高度的特异性以及强大的抗肿瘤免疫功能被广泛应用于各种恶性肿瘤的实验研究和临床治疗,尤其是在血液系统肿瘤领域取得很好的疗效。当然,CAR-T细胞不仅仅在血液系统肿瘤领域取得了较大突破,在实体肿瘤中同样被认为最有前景的肿瘤治疗方式之一。
那么,2020年,CAR-T细胞领域拥有诸多突破性进展,本文梅斯医学选取一些重磅级研究,带您一起回顾一下CAR-T细胞领域最有价值的研究进展。
免疫治疗在肿瘤治疗领域发挥重要作用,且不断取得新进展,尤以针对T细胞活化抑制性通路的单克隆抗体(也被称为免疫检查点抑制剂) 和嵌合抗原受体T细胞(CAR-T细胞)治疗最具代表性。目前,CAR-T细胞治疗在血液系统恶性肿瘤中取得了较好的结果,但同时也面临着很多亟待解决的问题。
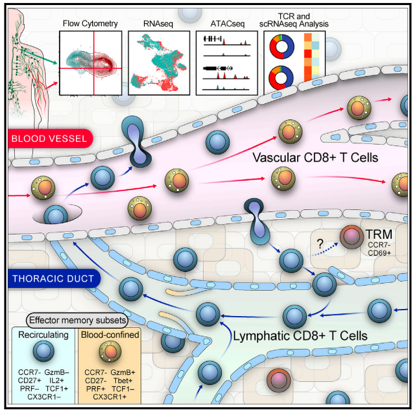
杀伤性T细胞一直被认为是免疫系统的主力军。每个杀伤性T细胞都携带像抗体受体一样的受体,可以识别特定的靶标。科学家们一直认为,杀伤性T细胞或多或少地从血液中循环到组织中,然后再循环到血液中,随时摧毁被识别的靶标。然而,12月10日,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员分析了人体和猕猴的血液和淋巴液样本发现,杀伤性T细胞通常会留在血液中,不会进入器官和其他组织,而且淋巴液中存在的CD8 T细胞,通常是血液以外的器官和其他组织中迁移的CD8 T细胞,而不是血液中大量存在的经典杀伤性T细胞。这一发现可能有助于解决免疫学中的许多难题。
 Cell 2020. doi:10.1016/j.cell.2020.11.019
Cell 2020. doi:10.1016/j.cell.2020.11.019
研究人员表示,这一发现扩展了人们对免疫细胞功能的深层理解,对基础免疫学的影响重大。同时,这些发现可能会为CAR-T细胞的研究设计、基因编码和细胞生产等带来更加成熟、安全和有效的细胞治疗技术。
与血液肿瘤不同,实体肿瘤微环境错综复杂,在微环境中,存在大量的纤维基质和免疫抑制细胞,而且往往伴随血管畸形和纤维结缔组织增生。来自宾夕法尼亚大学佩雷尔曼医学院等机构的研究人员研究发现,将CAR-T疗法与PAK4抑制剂药物相结合能促进工程化细胞攻击肿瘤。
 PAK4抑制使GBM对CAR-T免疫疗法产生敏感性.Nature Cancer. doi:10.1038/s43018-020-00147-8
PAK4抑制使GBM对CAR-T免疫疗法产生敏感性.Nature Cancer. doi:10.1038/s43018-020-00147-8
在这项研究中,研究人员通过对胶质母细胞瘤小鼠模型进行分析发现,抑制PAK4或能降低血管的异常,从而改善T细胞的浸润并抑制小鼠肿瘤的生长,大约80%PAK4被敲除的小鼠存活了至少60天,而所有野生型小鼠在肿瘤植入后的40天内发生了死亡。另外,利用EGFRvIII导向的CAR-T细胞疗法和PAK4抑制剂进行的研究中,研究者发现,相比输注5天后仅接受CAR-T细胞治疗的小鼠相比,联合治疗的小鼠机体中肿瘤的生长减少了近80%,而值得注意的是,即使其它组的小鼠在肿瘤植入后33天内发生了死亡,联合治疗组中仍然有40%的小鼠存活了下来。
这项研究结果与之前研究结论不谋而合,通过抑制PAK4所实现的血管标准化或能改善药物的运输,并降低肿瘤的缺氧状况,从而就能改善肿瘤对靶向性疗法、放疗和化疗的反应率。同时,这项研究进一步揭示了通过PAK3抑制剂来重编程整个血管微环境从而促进并改善癌症的细胞治疗。
研究人员表示,这种疗法或许并不仅仅局限于脑瘤,由于血管异常几乎是每一种实体瘤的常见共同特征,因此其还能被用于治疗诸如乳腺癌、胰腺癌等其它类型的癌症。
过继性T细胞疗法得以改善实体瘤的治疗,但仍面临严重不良反应及系统性毒性等局限,来自中国药科大学药物科学研究院张灿教授团队研发出一种更为安全有效的改善T细胞活力的策略。
研究团队建立了新型的T细胞表面锚定技术,通过模拟跨膜蛋白的特性,利用疏水作用力先将脂质锚定在T细胞膜上,再将脂质与药物脂质体通过点击反应偶联在T细胞膜上。
 T-Tre/BCN-Lipo-Ava细胞显示出增强的TCR集群和免疫学突触的形成,抗肿瘤反应得到改善.Science Translational Medicine, 12(571), eaaz6667. doi:10.1126/scitranslmed.aaz6667
T-Tre/BCN-Lipo-Ava细胞显示出增强的TCR集群和免疫学突触的形成,抗肿瘤反应得到改善.Science Translational Medicine, 12(571), eaaz6667. doi:10.1126/scitranslmed.aaz6667
研究人员将阿伐麦布(Avasimibe)与过继T细胞用于实体瘤联合治疗,结果发现,新型鼠源工程化TCR-T和人源工程化CAR-T分别在原位黑色素瘤、肺转移黑色素瘤及原位胶质母细胞瘤小鼠模型中展示出优异的治疗效果。其中,工程化CAR-T细胞在原位胶质母细胞瘤小鼠模型中的完全缓解率达到60%,且生存期延长至100天以上。并且这种联用策略具有较好的体内安全性。
研究者认为,工程化T细胞的给药没有产生明显的全身副作用,这些细胞表面锚定的工程T细胞由于其简单的生成和安全性,具有较高的转化潜力,也为细胞工程化改造提供了新技术。
肝癌是全球最常见的癌症致死原因之一,中国作为肝癌大国,整体上仍缺乏完善的筛查和规范的治疗体系,据数据显示,5年生存率目前只有约12%。目前,肝癌的主要治疗手段包括手术切除、放射和介入治疗,而这些治疗方式对机体副作用较大、疗效不确定,因而急需寻找新的有效的肝癌治疗策略。
来自中国上海交通大学医学院的研究人员首次报告了靶向磷脂酰肌醇蛋白聚糖3(GPC3)的CAR-T(CAR-GPC3 T)细胞疗法治疗肝细胞癌结果。
在这项研究中,研究人员对患有晚期GPC3+HCC(Child-Pugh A)的成年患者在环磷酰胺(cyclophosphamide)和氟达拉滨(fludarabine)诱导的淋巴细胞清除后,接受自体CAR-GPC3 T细胞治疗,并评估这种疗法的有效性和安全性。
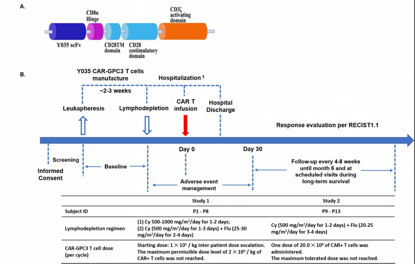 CAR-GPC3 T构建和研究设计示意图.Clin Cancer Res 2020; DOI: 10.1158/1078-0432.CCR-19-3259
CAR-GPC3 T构建和研究设计示意图.Clin Cancer Res 2020; DOI: 10.1158/1078-0432.CCR-19-3259
研究人员收纳了13名符合条件的患者,并给予中位数19.9×108个CAR-GPC3 T细胞治疗。结果发现,8名患者的CRS(1/2级)是可逆的。1例患者出现5级CRS。患者没有出现3~4级神经毒性。随访3年,1年和6个月的总生存率分别为10.5%、42.0%和50.3%。此外,研究人员证实有2名患者出现部分缓解,其中,1名患者病情稳定,在治疗44.2个月后仍然存活。CAR-GPC3 T细胞增殖与肿瘤反应呈正相关。
总体来说,本研究初步揭示了CAR-GPC3 T细胞疗法的安全性,且CAR-GPC3 T细胞在晚期肝细胞癌患者中具有抗肿瘤活性的早期迹象。
CAR-T疗法的方法已经成功地用于治疗淋巴瘤和白血病等血癌患者,CAR-T治疗通过添加能识别癌细胞表面独特特征的抗体片段来对患者自身的T细胞进行基因改造。在一项新的研究中,来自美国伊利诺伊大学厄本那香槟分校、芝加哥大学和丹麦哥本哈根大学的研究人员拓宽了潜在的具有短糖链连接的蛋白质靶标,通过基因改造的T细胞,对来自人类和小鼠的各种实体瘤癌细胞进行攻击。
在某些癌细胞上异常短的糖链是由突变导致的,这些突变破坏了这些糖与蛋白质连接的分子途径。研究人员从已知抗体与特定类型的异常糖相互作用开始,该糖与小鼠实体瘤癌细胞上的蛋白质相连。紧接着,研究人员测试了异常糖附近氨基酸序列的变化,以判断是否会影响受体与该位点的结合。
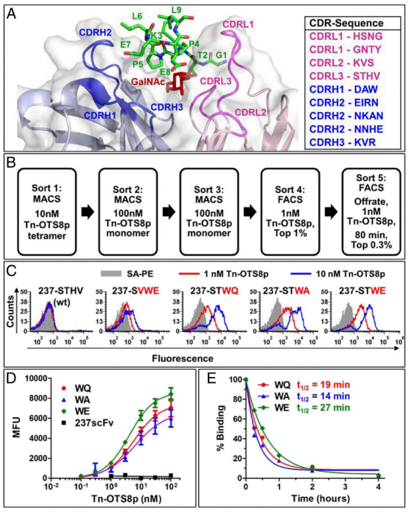 237-scFv与Tn-OTS8肽的亲和力更高.PNAS, 2020, doi:10.1073/pnas.1920662117.
237-scFv与Tn-OTS8肽的亲和力更高.PNAS, 2020, doi:10.1073/pnas.1920662117.
结果显示,Tn-聚糖侧翼的残基(Tn-OTS8)为相互作用提供了显着的结合能。用非同源人类抗原Tn-MUC1进行选择,可产生与多种Tn-糖蛋白广泛反应的scFv变异体。当配置为CAR时,表达这些scFv变体的工程T细胞表现出对O型糖基化缺陷的小鼠和人类癌细胞系改善的活性。T细胞现在可以识别带有短糖的几种不同蛋白质,与这些异常的糖链结合的药物可以优先识别癌细胞。
研究人员表示,癌细胞在其表面表达某些蛋白,这些蛋白是由于不同种类的突变而产生的。尽管这些工程化细胞尚处于早期开发阶段,但可以使用相同的T细胞产品来研究抗小鼠和人类癌症的功效和安全性。
发表在Science杂志上一项研究,公布了对3名患者进行基因编辑CAR-T治疗的I期临床试验结果。该研究首次证实了CRISPR / Cas9技术能够同时靶向人类多个基因的能力。经过CRISPR / Cas9基因编辑的CAR-T细胞可以在癌症患者体内持续存在几个月的时间,并且能够稳定增殖并发挥功能。
在传统的CAR T细胞疗法中,患者的免疫细胞经过遗传改造用来对抗癌症。而本次试验的方法有所差异。研究人员并没有给予T细胞转入任何靶向癌细胞抗原的CAR受体分子,而是首先使用CRISPR / Cas9编辑去除了3个关键基因。其中2个基因表达T细胞的天然受体,即TCRa与TCRb基因,第三个基因则表达PD-1,后者被认为是调控T细胞活性的关键“检查点”分子。
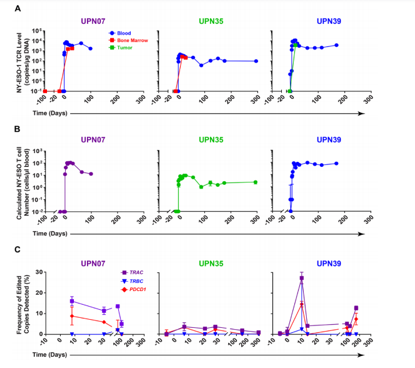 CRISPR-Cas9工程T细胞在患者体内的持续扩增和持久性.Science.DOI: 10.1126/science.aba7365
CRISPR-Cas9工程T细胞在患者体内的持续扩增和持久性.Science.DOI: 10.1126/science.aba7365
研究结果发现,相比原始的CAR-T细胞在体内不到一周的生存期,编辑后的细胞可在体内持续存在长达9个月的时间。在回输患者体内几个月后,研究人员抽取了更多血液,并分离了CRISPR编辑的细胞进行研究。结果表明,这些细胞仍然具有杀死肿瘤的能力。
研究人员表示,以前的研究表明这些细胞在几天之内就会失去功能,因此,这项研究中的CRISPR编辑细胞在单次输注后可以在更长的时间内保持抗肿瘤功能,这一事实令人鼓舞。
CD19 CAR-T细胞疗法已被美国食品药品管理局(FDA)批准用于治疗某些类型的血液癌症,即B细胞淋巴瘤和急性淋巴细胞白血病。来自美国希望之城的研究人员将2种强效的免疫疗法---溶瘤病毒(oncolytic virus)和嵌合抗原受体(CAR)T细胞(CAR-T)疗法结合起来,成功地靶向和根除单独用CAR-T细胞疗法很难治疗的实体瘤
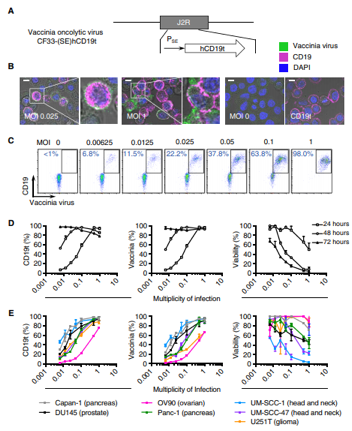 在体外,肿瘤分解病毒(OV)有效地将CD1t递送至实体瘤.Sci Transl Med. 2020 Sep 2;12(559):eaaz1863. doi: 10.1126/scitranslmed.aaz1863.
在体外,肿瘤分解病毒(OV)有效地将CD1t递送至实体瘤.Sci Transl Med. 2020 Sep 2;12(559):eaaz1863. doi: 10.1126/scitranslmed.aaz1863.
这项新的研究可能会扩大CD19 CAR-T细胞的使用范围,用于治疗可能患有任何实体瘤的患者。在这项研究中,研究人员通过对溶瘤病毒进行基因改造,使之进入肿瘤细胞,并诱导它们在肿瘤细胞表面上表达CD19蛋白。然后,使用靶向CD19的CAR-T细胞来识别和攻击这些实体瘤。
研究分析表明,CD19-CAR T细胞介导的肿瘤杀伤还诱导了垂死的肿瘤细胞释放病毒,从而传播了CD19t的肿瘤表达。而且,用溶瘤病毒和CAR T细胞组合治愈的癌症小鼠表现出保护性抗肿瘤免疫力的延长。这说明,免疫系统建立了对肿瘤的记忆反应。
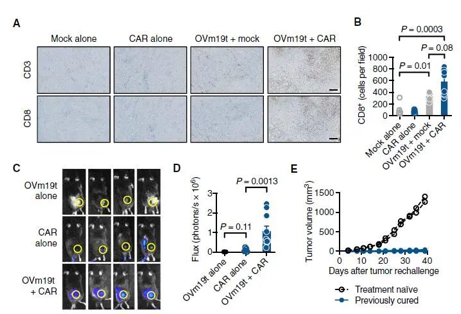 OVm19t促进内源性T细胞和过继转移的mCD19- CAR T细胞的肿瘤浸润.
OVm19t促进内源性T细胞和过继转移的mCD19- CAR T细胞的肿瘤浸润.
目前,研究人员正在设计一项临床试验,以对患者进行这种组合测试。该试验将首先测试OV19t在实体瘤患者中的安全性,如果发现这是安全有效的,则可以依次检测溶瘤病毒和CAR T细胞疗法。研究人员称,溶瘤病毒是一种强大而有前途的方法,可以与CAR-T细胞疗法战略性地结合起来,以便更有效地靶向实体瘤。
发表在Nat Med杂志的一项研究,研究人员描述了一种新型双CAR-T(Dual CAR T cell, Dual-CAR-T)细胞免疫疗法可以帮助对抗HIV感染。作为一种新型的CAR-T细胞,这种Dual-CAR-T细胞是通过对T细胞进行基因改造使得同一个T细胞表达两种CAR。每种CAR都携带一个CD4蛋白,使得它能够靶向HIV感染细胞,而且每种CAR还有一个共刺激结构域,用于向CAR-T细胞发出信号,增加这些T细胞的免疫功能。第一种CAR含有4-1BB共刺激结构域,可刺激细胞增殖和持久性,而第二种CAR具有CD28共刺激结构域,可增加这些T细胞杀伤HIV感染细胞的能力。
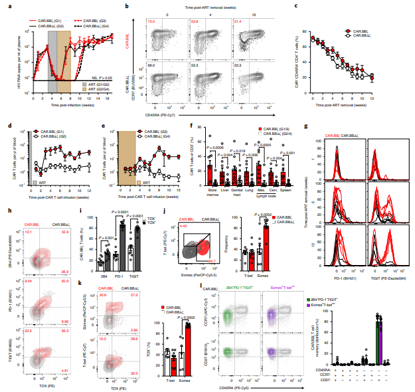 T细胞在无法控制病毒反弹后,表现出T细胞衰竭的特征.Nature Medicine. doi:10.1038/s41591-020-1039-5
T细胞在无法控制病毒反弹后,表现出T细胞衰竭的特征.Nature Medicine. doi:10.1038/s41591-020-1039-5
由于HIV经常感染T细胞,还添加了一种叫做C34-CXCR4的蛋白,这种蛋白可防止HIV附着在T细胞上,因而也就阻止这种病毒感染它们。最终产生的Dual-CAR-T细胞寿命长,在应对HIV感染时进行复制,有效杀灭被感染的细胞,并对HIV感染形成部分抵抗力。
当将受保护的Dual-CAR-T细胞给送到HIV感染的小鼠体内时,这些研究人员观察到HIV复制速度变得较慢,而且相比于未给送Dual-CAR-T细胞的小鼠,它们具有更少的HIV感染细胞。研究人员,观察到这些小鼠血液中的HIV病毒数量减少,CD4+T细胞得以保存下来。此外,当在HIV感染的小鼠中组合使用Dual-CAR-细胞细胞和ART时,这种病毒被更快地抑制,这就导致HIV病毒库比仅接受ART治疗的小鼠更小。
衰老是细胞老化的一个标志,并导致许多疾病。一种使免疫细胞靶向衰老细胞的新方法可能提供更好的治疗选择。衰老是细胞应激反应的一种形式。在某些情况下,它可能是有害的,人们正在努力开发针对衰老细胞的疗法。
研究人员,采用了一种目前用于抗癌治疗的技术。在这种疗法中,T细胞从个体中移除,在回输之前,对其进行操作,以增强其针对癌细胞的能力。这种细胞被称为CAR T细胞,因为它们被设计成表达所谓的嵌合抗原受体(CAR)。CAR的设计目的是识别并结合存在于癌细胞表面的 一种称为抗原的蛋白质的特定片段。如果这种相互作用发生,T细胞就会被激活并杀死肿瘤细胞。识别只在肿瘤细胞上表达的抗原是一个关键的挑战,因为CAR T细胞杀死健康细胞可能导致严重的副作用。
为了找到针对衰老细胞的抗原,研究人员分析了衰老的人和小鼠细胞中发现的跨膜蛋白的表达。对先前发表的关于人类组织中蛋白和RNA表达的数据进行的检查显示,uPAR要么未被检测到,要么,在人体的大部分器官(包括中枢神经系统、心脏和肝脏)中以低水平存在。然而,研究人员发现uPAR在体内和体外衰老细胞中都有高表达。有趣的是,缺乏跨膜区域的一种可溶性uPAR (suPAR)是SASP反应期间分泌的一种成分。suPAR的存在是一些慢性疾病的标志,包括糖尿病和肾病 ,衰老在这些疾病中起作用。
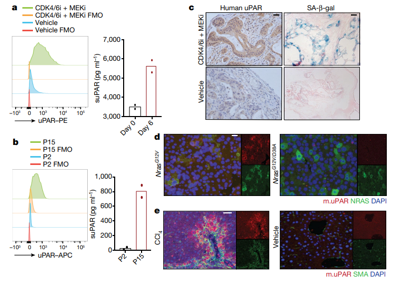 uPAR是一种细胞表面和分泌的衰老生物标志物.2020 Nature https://doi.org/10.1038/s41586-020-2403-9
uPAR是一种细胞表面和分泌的衰老生物标志物.2020 Nature https://doi.org/10.1038/s41586-020-2403-9
在确定uPAR作为衰老细胞的普遍标志后,研究人员设计了靶向uPAR的CAR T细胞。鉴于癌变前的细胞(那些可能在成为癌细胞)出现衰老以及很多抗癌治疗导致肿瘤细胞进入衰老来阻止他们的分裂,研究人员调查了这些CAR T细胞是否可以有效治疗癌症。
研究结果显示,以 uPAR为靶点的CAR T细胞治疗可以消除小鼠肝癌和肺癌模型中衰老的前恶性和恶性细胞。已经有人提出,通过后续针对衰老细胞的治疗,抗癌疗法可能会得到改善。研究人员在小鼠身上的研究证实了这种使用具有senolytic CAR T细胞的方法提高了抗癌治疗的有效 性。
使用senolytic CAR - T细胞的部分吸引力在于其治疗衰老涉及的许多疾病的潜力。事实上,该研究证明,如果小鼠接受senolytic CAR T细胞治疗,可以改善非酒精性脂肪性肝炎(一种严重的脂肪肝)动物模型的肝纤维化结果。
8月18日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)许琛琦研究组与上海科技大学王皞鹏课题组以及复旦大学附属眼耳鼻喉科医院吴海涛课题组在国际学术期刊Immunity上以封面文章的形式发表了一项研究,提出了一种新型的“可循环CAR”设计方案,显著提高了CAR-T细胞在体内的持续活性和抗肿瘤效果,为防止CAR-T治疗后的肿瘤复发提供了新策略。
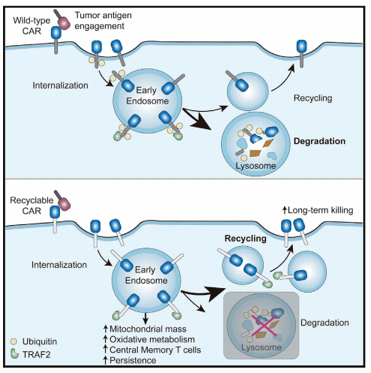 Immunity. doi:10.1016/j.immuni.2020.07.011
Immunity. doi:10.1016/j.immuni.2020.07.011
在该项研究中,研究人员首次证明了CAR受体在结合肿瘤抗原后会发生泛素化修饰及溶酶体介导的CAR的降解,从而导致细胞表面CAR受体水平显著 下调。研究人员进一步把CAR胞内段的泛素化位点赖氨酸K突变为精氨酸R(CARKR),阻断了CAR的泛素化修饰及溶酶体的降解,抑制了CAR的下调过程。改造后的CAR相较于传统的CAR能够赋予T细胞更强的抗肿瘤效果和持续活性。
机制性探索发现,改造后的CAR在T细胞中循环(recycling),并在激活后富集在胞内内体(endosome)中,其胞内段4-1BB结构域仍然结合着信号传递分子TRAF2,在胞内执行信号传递功能,因而增强了4-1BB下游信号,促进了T细胞的代谢重编程(提高线粒体的生成及氧化磷酸化代谢)及中央型记忆T细胞的分化。研究团队将这种全新的设计命名为可循环CAR(Recyclable CAR)。这些结果为后续可循环CAR的临床验证提供了坚实的基础。